Q = m c ( Tf - Ti )
dove m é la massa; c é il calore specifico e ( Tf - Ti ) é la variazione di temperatura.
Le leggi della termodinamica affermano che se il sistema é isolato, allora la quantità di calore ceduta da un corpo é pari a quella acquista dall’altro. Il nostro sistema sperimentale é formato da una certa quantità di acqua e da delle piastre di metallo, il tutto contenuto in un calorimetro, quindi la perdita di calore é minima e comunque possibile da calcolare. Si può quindi scrivere che in questo caso la quantità di calore ceduta dal metallo é in relazione con quella acquistata dall’acqua, secondo questa formula:
ma ca (Tf - Tai ) = mM cM (Tf - TMi )
In questa relazione però non si tiene conto della presenza del calorimetro nel sistema , quindi dato che anche questo può disperdere una certa quantità di calore, abbiamo considerato anche l’equivalente in acqua del calorimetro, così da avere solo due quantità in gioco:
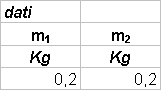
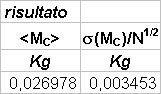
mc = m2
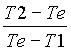 - m1
- m1
dove mc é l’equivalente della massa del calorimetro in acqua (quantità che andrà aggiunta alla massa reale dell’acqua); le due masse sono quantità d’acqua a diverse temperature T1 e T2, mentre la Te é la temperatura di equilibrio del sistema.