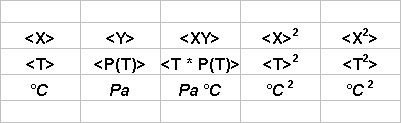
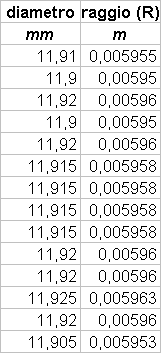
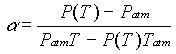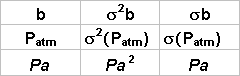P(T) = P0 (1+a T)
(P = pressione, T = temperatura)
Se la condizione iniziale é tale che T = T0 si puó scrivere la relazione:
P(T0) = P0 (1+a T0)
Mettendo a sistema questa relazione con la precedente otteniamo:
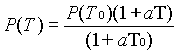
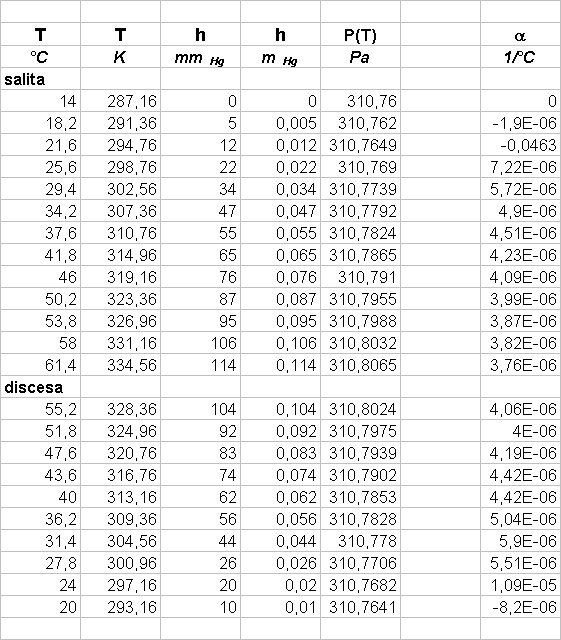
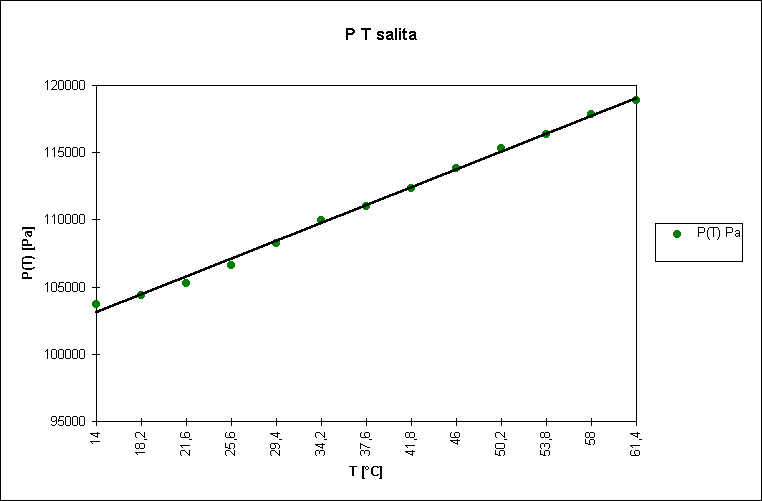
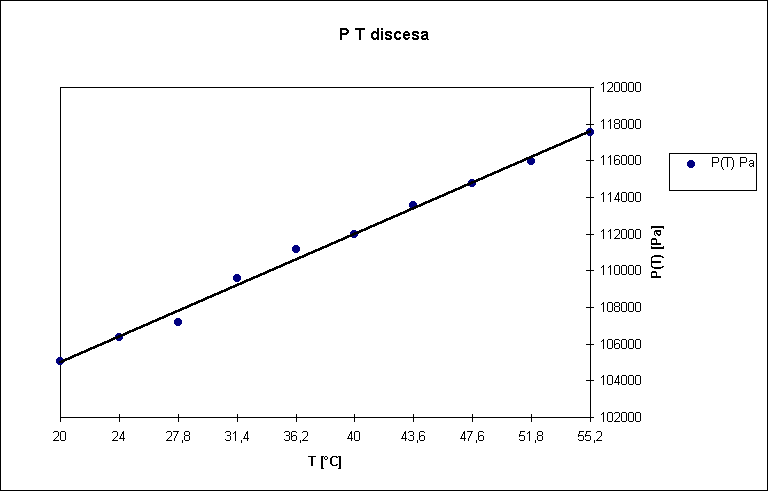
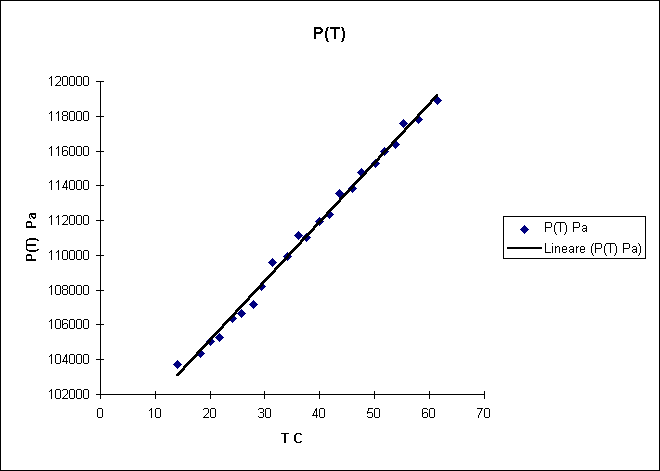
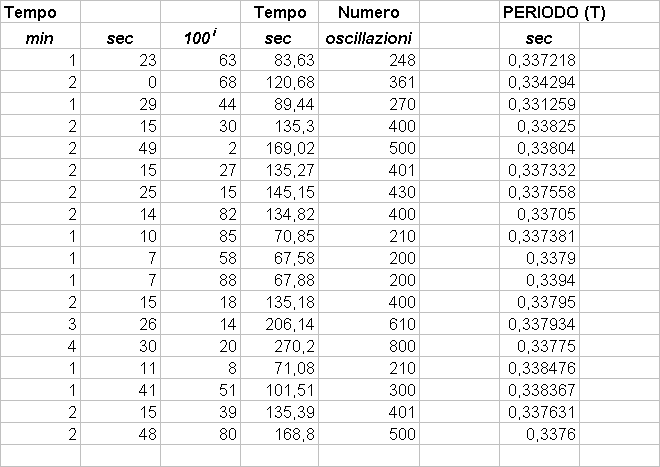
Scopo di questo esperimento é calcolare a e stimarne l’errore.
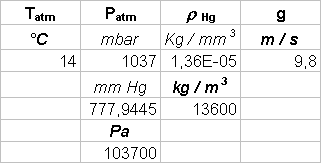
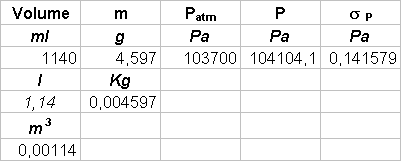
Abbiamo aumentato la temperatura dell’aria contenuta nell’ampolla il cui volume poteva essere considerato costante, aumentando cosí proporzionalmente la pressione (in accordo con la legge di stato dei gas); in questo modo l’aria contenuta nell’ampolla comprimeva il mercurio contenuto nel capillare. Il mercurio nel capillare era sottoposto a due diverse pressioni: in un braccio del capillare era sottoposto alla pressione dell’aria dell’ampolla, nell’altro alla pressione atmosferica; dato che le due pressioni erano differenti il mercurio non era alla stesso livello nei due bracci e il D h tra i due livelli permetteva di calcolare la differenza fra la pressione atmosferica e la pressione dell’aria contenuta nell’ampolla. Se poniamo P(T0) = P atmosferica allora possiamo utilizzare la seguente relazione:
r Hg D h g = P(T) - P(T0) = P(T) - Patm